Indikationen, wichtige Sicherheitsinformationen und Verschreibungsinformationen
BOTOX® Kosmetische (OnabotulinumtoxinA) Wichtige Informationen
Indikationen
BOTOX® Cosmetic (OnabotulinumtoxinA) ist bei erwachsenen Patienten zur vorübergehenden Verbesserung des Erscheinungsbildes von:
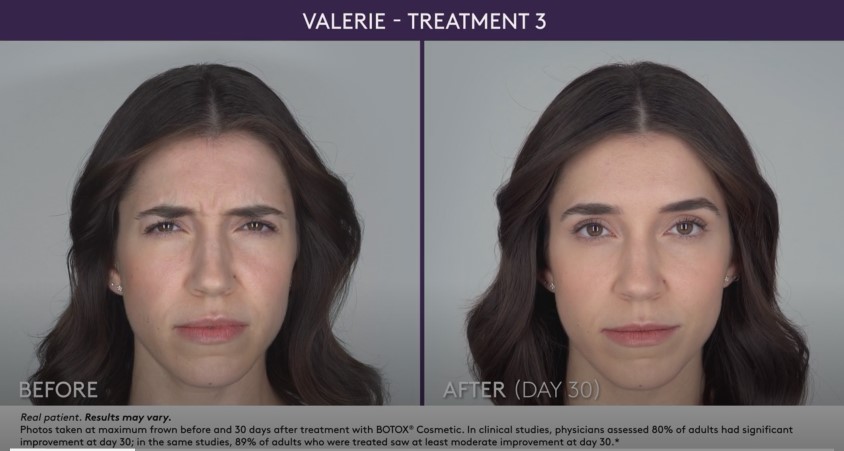
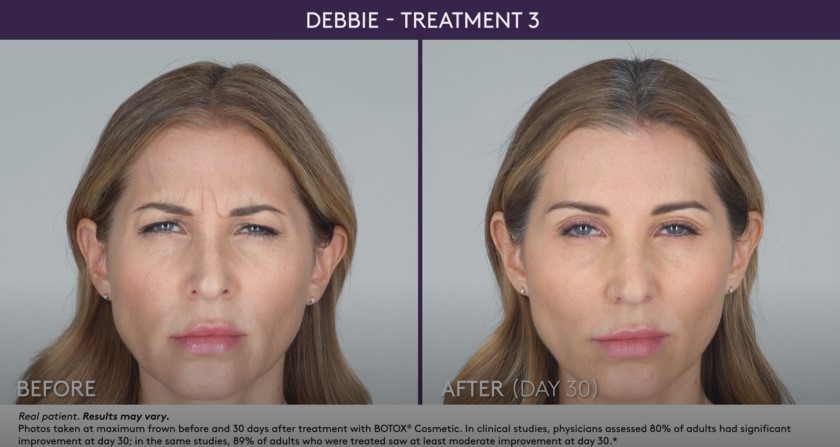
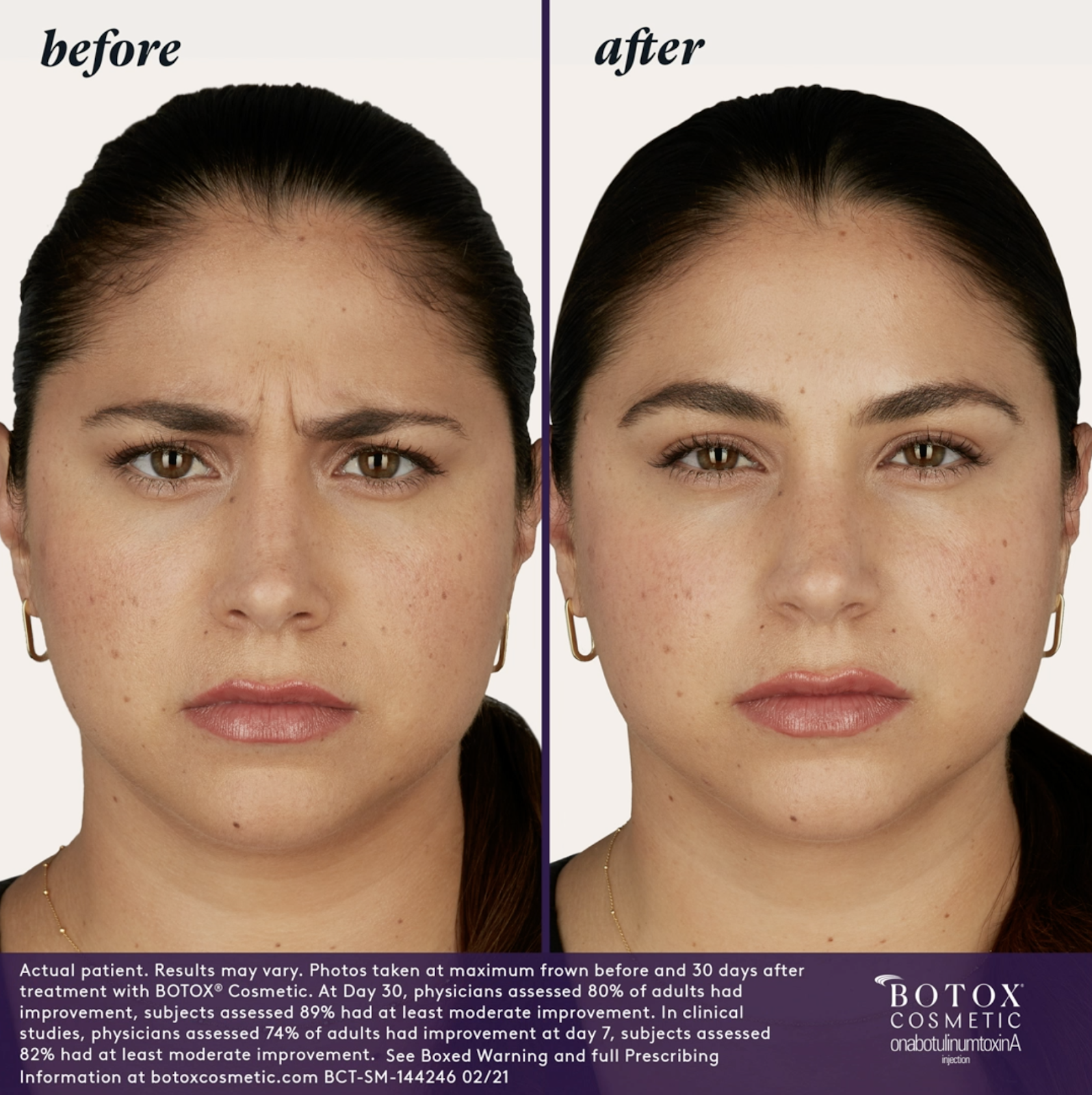
– Mäßige bis schwere Glabellafalten in Verbindung mit Corrugator- und/oder Procerus-Muskelaktivität
– Mäßige bis schwere seitliche Augenfalten in Verbindung mit Orbicularis oculi-Aktivität
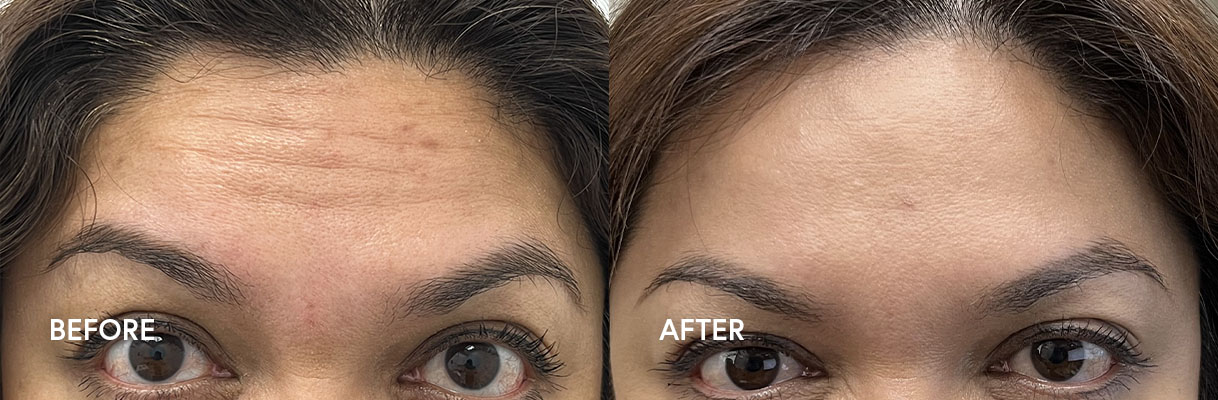
– Mäßige bis starke Stirnfalten im Zusammenhang mit Frontalis-Aktivität
WICHTIGE SICHERHEITSINFORMATIONEN, EINSCHLIESSLICH UMKÄSTEN WARNHINWEISE
WARNUNG: FERNE AUSBREITUNG VON TOXIN WIRKUNG
Berichte aus der Zeit nach der Markteinführung deuten darauf hin, dass sich die Wirkung von BOTOX® Cosmetic und allen Botulinumtoxin-Produkten vom Injektionsbereich ausbreiten und Symptome hervorrufen kann, die mit der Wirkung von Botulinumtoxin in Einklang stehen. Dazu können Asthenie, allgemeine Muskelschwäche, Diplopie, Ptosis, Dysphagie, Dysphonie, Dysarthrie, Harninkontinenz und Atembeschwerden gehören. Diese Symptome wurden Stunden bis Wochen nach der Injektion berichtet. Schluck- und Atembeschwerden können lebensbedrohlich sein und es gibt Berichte über Todesfälle. Das Risiko von Symptomen ist wahrscheinlich bei Kindern, die wegen Spastik behandelt werden, am größten, aber Symptome können auch bei Erwachsenen auftreten, die wegen Spastik und anderen Erkrankungen behandelt werden, insbesondere bei Patienten, die eine Grunderkrankung haben, die sie für diese Symptome prädisponieren würde. Bei nicht zugelassenen Anwendungen und zugelassenen Indikationen wurde über Fälle einer Wirkungsausbreitung bei Dosen berichtet, die mit denen zur Behandlung von zervikaler Dystonie und Spastik vergleichbar sind, sowie bei niedrigeren Dosen.
KONTRA
BOTOX® Cosmetic ist kontraindiziert bei Vorliegen einer Infektion an der/den vorgesehenen Injektionsstelle(n) und bei Personen mit bekannter Überempfindlichkeit gegen ein Botulinumtoxinpräparat oder einen der Bestandteile der Formulierung.
WARNUNGEN UND VORSICHTSMASSNAHMEN
Mangelnde Austauschbarkeit zwischen Botulinumtoxin-Produkten
Die Wirkstärkeeinheiten von BOTOX® Cosmetic sind spezifisch für die verwendete Zubereitungs- und Testmethode. Sie sind nicht mit anderen Zubereitungen von Botulinumtoxin-Produkten austauschbar und daher können Einheiten der biologischen Aktivität von BOTOX® Cosmetic nicht mit Einheiten anderer Botulinumtoxin-Produkte verglichen oder in Einheiten anderer Botulinumtoxin-Produkte umgerechnet werden, die mit einer anderen spezifischen Testmethode bewertet wurden.
Ausbreitung der Toxinwirkung
Bitte beachten Sie den umrandeten Warnhinweis zur Fernausbreitung der Toxinwirkung.
Keine definitiven Berichte über schwerwiegende unerwünschte Ereignisse über eine weit entfernte Ausbreitung der Toxinwirkung im Zusammenhang mit der dermatologischen Anwendung von BOTOX® Cosmetic in der angegebenen Dosis von 20 Einheiten (für Glabellafalten), 24 Einheiten (für seitliche Lidfalten), 40 Einheiten (für Stirnfalten mit Glabellafalten). Es wurden 44 Einheiten (zur gleichzeitigen Behandlung von seitlichen Augenwinkelfalten und Glabellafalten) und 64 Einheiten (zur gleichzeitigen Behandlung von seitlichen Augenwinkellinien, Glabellafalten und Stirnfalten) gemeldet. Patienten oder Pflegepersonal sollten angewiesen werden, sofort einen Arzt aufzusuchen, wenn Schluck-, Sprach- oder Atemstörungen auftreten.
Schwerwiegende Nebenwirkungen bei nicht genehmigter Verwendung
Schwerwiegende Nebenwirkungen, einschließlich übermäßiger Schwäche, Dysphagie und Aspirationspneumonie, wobei einige Nebenwirkungen mit tödlichem Ausgang einhergingen, wurden bei Patienten berichtet, die BOTOX®-Injektionen für nicht genehmigte Anwendungen erhielten. In diesen Fällen standen die Nebenwirkungen nicht unbedingt im Zusammenhang mit der Ausbreitung des Toxins über große Entfernungen, sondern könnten auf die Verabreichung von BOTOX® an der Injektionsstelle und/oder angrenzenden Strukturen zurückzuführen sein. In mehreren Fällen hatten die Patienten bereits eine Dysphagie oder andere erhebliche Behinderungen. Es liegen nicht genügend Informationen vor, um Faktoren zu identifizieren, die mit einem erhöhten Risiko für Nebenwirkungen im Zusammenhang mit der nicht genehmigten Anwendung von BOTOX® verbunden sind. Die Sicherheit und Wirksamkeit von BOTOX® bei nicht zugelassenen Anwendungen wurde nicht nachgewiesen.
Überempfindlichkeitsreaktionen
Es wurden schwerwiegende und/oder sofortige Überempfindlichkeitsreaktionen berichtet. Zu diesen Reaktionen gehören Anaphylaxie, Serumkrankheit, Urtikaria, Weichteilödeme und Atemnot. Wenn solche Reaktionen auftreten, sollte die weitere Injektion von BOTOX® Cosmetic abgebrochen und sofort eine geeignete medizinische Therapie eingeleitet werden. Es wurde über einen tödlichen Fall einer Anaphylaxie berichtet, bei dem Lidocain als Verdünnungsmittel verwendet wurde und daher der Auslöser nicht zuverlässig bestimmt werden kann.
Herz-Kreislauf-System
Nach der Verabreichung von BOTOX® gab es Berichte über unerwünschte Ereignisse im Herz-Kreislauf-System, einschließlich Herzrhythmusstörungen und Myokardinfarkt, einige davon mit tödlichem Ausgang. Einige dieser Patienten hatten Risikofaktoren, darunter bereits bestehende Herz-Kreislauf-Erkrankungen. Bei der Verabreichung an Patienten mit bereits bestehenden Herz-Kreislauf-Erkrankungen ist Vorsicht geboten.
Erhöhtes Risiko klinisch signifikanter Wirkungen bei vorbestehenden neuromuskulären Erkrankungen
Personen mit peripheren motorischen neuropathischen Erkrankungen, amyotropher Lateralsklerose oder Störungen der neuromuskulären Synapsen (z. B. Myasthenia gravis oder Lambert-Eaton-Syndrom) sollten überwacht werden, wenn sie Botulinumtoxin erhalten. Bei Patienten mit neuromuskulären Erkrankungen besteht möglicherweise ein erhöhtes Risiko für klinisch signifikante Wirkungen, einschließlich allgemeiner Muskelschwäche, Diplopie, Ptosis, Dysphonie, Dysarthrie, schwerer Dysphagie und Beeinträchtigung der Atemwege durch OnabotulinumtoxinA (sehen Warnungen und Vorsichtsmaßnahmen).
Dysphagie und Atembeschwerden
Die Behandlung mit BOTOX® und anderen Botulinumtoxin-Produkten kann zu Schluck- oder Atembeschwerden führen. Patienten mit bereits bestehenden Schluck- oder Atembeschwerden sind möglicherweise anfälliger für diese Komplikationen. In den meisten Fällen ist dies eine Folge einer Schwächung der Muskeln im Injektionsbereich, die an der Atmung beteiligt sind, oder der oropharyngealen Muskulatur, die das Schlucken oder Atmen kontrolliert (siehe Boxed Warnung).
Vorerkrankungen an der Injektionsstelle
Vorsicht ist geboten, wenn die Behandlung mit BOTOX® Cosmetic bei Vorliegen einer Entzündung an der/den vorgesehenen Injektionsstelle(n) oder bei übermäßiger Schwäche oder Atrophie des Zielmuskels/der Zielmuskeln angewendet wird.
Trockenes Auge bei Patienten, die mit BOTOX® Cosmetic behandelt werden
Es gab Berichte über trockene Augen im Zusammenhang mit der Injektion von BOTOX® Cosmetic in oder in der Nähe des Musculus orbicularis oculi. Wenn die Symptome eines trockenen Auges (z. B. Augenreizung, Photophobie oder Sehveränderungen) bestehen bleiben, sollten Sie den Patienten an einen Augenarzt überweisen.
Humanalbumin und Übertragung von Viruserkrankungen
Dieses Produkt enthält Albumin, ein Derivat des menschlichen Blutes. Basierend auf einem effektiven Spender-Screening und Produktherstellungsverfahren birgt es ein äußerst geringes Risiko für die Übertragung von Viruserkrankungen und der Variante der Creutzfeldt-Jakob-Krankheit (vCJD). Es besteht ein theoretisches Risiko für die Übertragung der Creutzfeldt-Jakob-Krankheit (CJD), aber wenn dieses Risiko tatsächlich besteht, würde das Übertragungsrisiko auch als äußerst gering angesehen. Für lizenziertes Albumin oder Albumin, das in anderen lizenzierten Produkten enthalten ist, wurden noch nie Fälle einer Übertragung von Viruserkrankungen, CJD oder vCJD festgestellt.
NEBENWIRKUNGEN
Die am häufigsten berichteten Nebenwirkungen nach der Injektion von BOTOX® Cosmetic gegen Glabellafalten waren Augenlid-Ptosis (3 %), Gesichtsschmerzen (1 %), Fazialisparese (1 %) und Muskelschwäche (1 %).
Die am häufigsten berichtete Nebenwirkung nach der Injektion von BOTOX® Cosmetic bei seitlichen Lidfalten war ein Augenlidödem (1 %).
Die am häufigsten berichteten Nebenwirkungen nach Injektion von BOTOX® Cosmetic bei Stirnfalten mit Glabellafalten waren Kopfschmerzen (9 %), Brauen-Ptosis (2 %) und Augenlid-Ptosis (2 %).
WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN
Die gleichzeitige Anwendung von BOTOX® Cosmetic und Aminoglykosiden oder anderen Wirkstoffen, die die neuromuskuläre Übertragung beeinträchtigen (z. B. Curare-ähnliche Verbindungen), sollte nur mit Vorsicht erfolgen, da die Wirkung des Toxins verstärkt werden kann. Die Verwendung von Anticholinergika nach der Verabreichung von BOTOX® Cosmetic kann systemische anticholinerge Wirkungen verstärken.
Die Wirkung der gleichzeitigen Verabreichung verschiedener Botulinum-Neurotoxin-Produkte oder innerhalb mehrerer Monate ist nicht bekannt. Eine übermäßige neuromuskuläre Schwäche kann durch die Verabreichung eines anderen Botulinumtoxins verschlimmert werden, bevor die Wirkungen eines zuvor verabreichten Botulinumtoxins abgeklungen sind.
Eine übermäßige Schwäche kann auch durch die Verabreichung eines Muskelrelaxans vor oder nach der Verabreichung von BOTOX® Cosmetic verstärkt werden.
VERWENDUNG IN SPEZIFISCHEN BEVÖLKERUNGEN
Es liegen keine Studien oder ausreichenden Daten aus der Postmarketing-Überwachung zum Entwicklungsrisiko vor, das mit der Anwendung von BOTOX® Cosmetic bei schwangeren Frauen verbunden ist. Es liegen keine Daten zum Vorhandensein von BOTOX® Cosmetic in menschlicher oder tierischer Milch, zu den Auswirkungen auf das gestillte Kind oder zu den Auswirkungen auf die Milchproduktion vor.
Siehe BOTOX® Kosmetik voll Verschreibungsinformationen einschließlich Boxed Warning und Leitfaden für Medikamente.
Kontaktieren Sie uns noch heute
Bitte füllen Sie das untenstehende Formular aus, und jemand wird in Kürze antworten. Sie können auch anrufen 516-833-1301 mit allen Fragen, die Sie haben können.